prof. muDr. michal z ikán, ph.D. a kolektiv
Onk O gynek O lO gie
1 Základní PO jmy v O nk O lO gii
Michal Zikán, Borek Sehnal, j iří Sláma1.1 s taG in G V onko G yn E kolo G ii
Borek Sehnal, j iří Sláma
z ákla D ní fakta
• Staging určuje stadium (rozsah) maligního nádoru.
• Staging FIGO rozlišuje čtyři stadia.
• Staging TNM popisuje izolovaně postižení tumoru (T), regionálních lymfatických uzlin (N), metastáz (M).
• Stagingové systémy jsou pravidelně revidovány.
Úvod
Vypracování stagingového systému a určení stadia maligního nádoru je jedním ze základních aktivit v onkologii a má zásadní význam v managementu maligních onemocnění. Jednotlivá stadia stagingového systému vycházejí z komplexního biologického chování tumoru a vyjadřují prognózu pacienta. První stagingový systém gynekologických nádorů byl vytvořen na přelomu 20. století pro karcinom děložního hrdla. Vypracování klasifikace ostatních gynekologických nádorů následovalo v 50. letech minulého století. Během následujících dekád se tyto stagingové systémy s výjimkou cervikálního karcinomu a trofoblastické nemoci přesunuly z klinické na chirurgickou (patologicko-anatomickou) základnu.
o becné zásady stagingu
Každý dobrý stagingový systém by měl mít tři základní charakteristiky – měl by být odůvodněný (vytvořený na základě poznatků evidence-based medicine), solidní (co nejvíce důvěryhodný pro všechny zdravotnické systémy) a praktický (snadno uplatnitelný v praxi, user-friendly). Stagingový systém musí být jasně definovaný, identickým případům zhoubného nádoru musí být vždy přiřazena stejná stadia onemocnění. Stagingový systém musí být také vhodný pro celý svět a snadno aplikovatelný ve všech zemích s odlišnou úrovní zdravotní péče.
Zařazení tumoru do jednotlivých stadií nesmí vyžadovat složitá nebo vysoce specializovaná diagnostická vyšetření, ale takové postupy, které jsou dostupné v naprosté většině zdravotnických zařízení ve světě. Aby si stagingový systém zachoval svoji odůvodnitelnost, musí být staging přístupný změnám a pravidelně revidován na základě nejnovějších poznatků vědy.
Mezi hlavní cíle dobrého stagingového systému patří stanovení prognózy onemocnění, plánování terapie a možnost výměny relevantních informací mezi onkologickými centry celého světa. Zprostředkování poznatků o úspěšnosti léčby v závislosti na stadiu onemocnění napříč světadíly umožňuje srovnání účinnosti rozdílných léčebných postupů. I z těchto důvodů nebyla pro jednotlivá stadia konkrétních malignit vytvořena jednoznačná neměnná terapie, ale určitá doporučení léčby, se kterými nemusí být všeobecný souhlas. Onkologie jednoznačně profituje z široce používaného stagingu, který z podobných skupin pacientů generuje nová data usnadňující další výzkum. Na druhé straně existují silné rizikové faktory, které nemění stadium onemocnění, ale významně ovlivňují prognózu pacienta i management léčby a měly by být v lékařské zprávě uvedeny. Jedná se např. o stupeň dediferenciace maligní tkáně (tzv. grade) a přítomnost vaskulární invaze nebo lymfangioinvaze při histologickém vyšetření nebo molekulární testovaní somatických mutací (např. geny POLE a p53 u karcinomu endometria). V budoucnu se plánuje přijmout další změny, které budou pracovat s novými molekulárními markery a mechanismy. Umožní lépe porozumět dědičným faktorům a genetickým aberacím uplatňujících se v etiologii a patogenezi jednotlivých nádorů. Další snaha bude zaměřena na řešení sporných otázek, jako je přítomnost reziduálního tumoru po léčbě, protože velikost reziduálního nádoru patří mezi nejpřesvědčivější prognostické faktory po terapii; diskutuje se možnost zahrnout do klasifikace způsob šíření nádoru, detekci izolovaných nádorových buněk v regionálních lymfatických uzlinách, krvi, kostní dřeni nebo v jiných biopsiích, respektive využití metody sentinelové lymfatické uzliny (SLN).
s tagingové systémy v onkogynekologii
Problematiku stagingu v onkogynekologii zastřešují tři velké organizace – FIGO, UICC a AJCC. Mezinárodní federace gynekologie a porodnictví FIGO (Fédération Internationale de Gynécologie et d’Obstétrique, The International Federation of Gynecology and Obstetrics) byla založena v roce 1954 v Ženevě a v současnosti shromažďuje odborné gynekologicko-porodnické společnosti z více než 130 zemí pěti kontinentů. Jedna z hlavních komisí FIGO je zaměřena na návrhy změn stagingových systémů ženských zhoubných nádorů. Mezinárodní výbor proti rakovině UICC (International Union Against Cancer) založil v roce 1950 Komisi pro nádorovou nomenklaturu a statistiku (Committee on Tumour Nomenclature and Statistics). Po několika změnách názvu tohoto orgánu se od roku 1994 jmenuje Komise pro TNM prognostické faktory (TNM Prognostic Factor Project Committee). V roce 1954 se UICC a FIGO spojili do společné komise s cílem vytvoření pravidel pro klasifikaci klinického stagingu zhoubných nádorů a prezentací výsledků léčby. TNM klasifikace (tumor-node-metastasis) pro zhoubné nádory děložního hrdla byla navržena touto komisí v roce 1966, což bylo velké uznání zkušeností a dat získaných pomocí stagingu FIGO. Dosažení všeobecné shody v klasifikaci anatomického rozsahu onemocnění zůstává pro UICC trvalým cílem. Americká společná komise pro malignity AJCC (American Joint Committee on Cancer) a Americký společný výbor pro staging malignit (American Joint Committee for Cancer Staging) začaly v roce 1959 spolupracovat na vývoji klinického stagingového systému nádorů, který by byl vhodný pro lékaře praktikující ve Spojených státech. Byl navržen systém založený na TNM klasifikaci, v roce 1976 AJCC přijala rozvržení stadií systému gynekologických zhoubných nádorů podle FIGO. Systém TNM je tedy podporován organizacemi UICC a AJCC. Pacientky by měly být primárně klasifikovány podle systému TNM, ale staging FIGO by měl být vždy také uveden.
s taging fi G o
Stagi N g F igo
Nádor rozdělen do čtyř stadií podle šíření nemoci:
• stadium I: tumor nepřesahuje orgán svého původu
• stadium II: šíření nádoru na přilehlé orgány
• stadium III: postižení dalších orgánů nebo regionálních lymfatických uzlin
• stadium IV: vzdálené metastázy
Organizace FIGO vypracovala první stagingový systém gynekologických nádorů pro karcinom děložního hrdla, poté následovaly stagingové systémy pro další ženské malignity. Vedle svých stěžejních celosvětových projektů FIGO, mezi které patří snížení mateřské a novorozenecké mortality převážně v rozvojových zemích, je jeden z hlavních orgánů FIGO zaměřen na onkogynekologii – FIGO Committee on Gynecologic Oncology. Do jeho portfolia spadají i návrhy změn ve stagingových klasifikacích ženských malignit podle nejnovějších znalostí medicíny založené na důkazech (evidence based medicine). Během posledních 80 let stagingové systémy gynekologických nádorů byly opakovaně upravovány, aby kopírovaly obrovský rozmach v lékařském výzkumu i léčbě. Změny v klasifikaci FIGO jsou vždy časem odsouhlaseny organizacemi UICC a AJCC, aby oba stagingové systémy (FIGO a TNM) byly co nejvíce identické.
Klasifikace nádoru podle FIGO je vždy rozdělena do čtyř stadií na základě klinického a/nebo patologicko-anatomického šíření nemoci. Stadium I popisuje tumor, který nepřesahuje orgán svého původu, tedy tumory poměrně malé. Stadium II popisuje šíření nádoru na přilehlé orgány, stadium III zachycuje už pokročilejší stadium nemoci s postižením dalších orgánů a stadium IV reprezentuje vzdálené metastázy. Tyto čtyři základní stadia se dále dělí do substadií, která lépe odrážejí specifické klinické, patologicko-anatomické a prognostické faktory onemocnění.
V některých případech by se měla zaznamenat metoda průkazu postižení lymfatických uzlin přidáním písmene „r“ v případě zobrazovací metody a písmene „p“ v případě chirurgického (patologického) stagingu, např. u karcinomu děložního hrdla by se při pozitivitě suprapánevních lymfatických uzlin mělo uvést IIIC2r nebo IIIC2p. Vždy by měla být také uvedena technika zobrazovací metody nebo patologického vyšetření, v případě nejasností se uvádí nižší stadium. V současnosti FIGO striktně nedoporučuje žádnou zobrazovací metodu a konečné stadium by mělo být určeno až na základě výsledku všech vyšetření.
tabulka 1.4 Léčiva ze skupiny cílené (biologické) léčby nejčastěji používaná v onkogynekologii
látka Struktura
Mechanismus účinku
indikace –nádor indikace – použití
bevacizumab protilátka proti VEGF antiangiogenní karcinom ovaria primární léčba platina rezistentní recidiva
karcinom děložního hrdla recidivující, perzistující, metastatický nádor
lenvatinib inhibitor tyrosinkinázové aktivity receptoru pro VEGF antiangiogenní karcinom endometria progrese po léčbě platinovým derivátem (pokročilý nebo recidivující nádor), pMMR nádor
olaparib inhibitor PARP1 inhibice PARP karcinom ovaria primární léčba pokročilého nádoru, germinální nebo somatická mutace genů BRCA1 a BRCA2
platina senzitivní recidiva, germinální nebo somatická mutace genů BRCA1 a BRCA2
karcinom prsu lokálně pokročilý nebo metastazující karcinom, HER2/ neu negativní, nositelky mutace genu BRCA1 a BRCA2 niraparib inhibitor PARP1 a PARB2 inhibice PARP karcinom ovaria primární léčba pokročilého nádoru, bez ohledu na mutační status
pembrolizumab protilátka proti PD1 imunoterapie, checkpoint inhibitor karcinom děložního hrdla recidivující, perzistující, metastatický nádor
karcinom endometria progrese po léčbě platinovým derivátem (pokročilý nebo recidivující nádor), dMMR nádor
dostarlimab protilátka proti PD1
atezolizumab protilátka proti PD L1
durvalumab protilátka proti PD L1
cemiplimab protilátka proti PD L1
imunoterapie, checkpoint inhibitor karcinom endometria progrese po léčbě platinovým derivátem (pokročilý nebo recidivující nádor), dMMR nádor
imunoterapie, checkpoint inhibitor karcinom děložního hrdla použití v klinický studiích
imunoterapie, checkpoint inhibitor karcinom ovaria použití v klinických studiích
imunoterapie, checkpoint inhibitor karcinom děložního hrdla progrese na nebo po léčbě platinovými deriváty, bez ohledu na status PD L1
Dle koncovky názvu léčiva se dá odhadnout jeho mechanismus účinku:
• -ib – inhibitor (zpravidla menší molekula, často v perorální formě)
• -mab – monoklonální protilátka (monoclonal antibody), velká molekula podávaná parenterálně V onkogynekologii se užívají zejména látky ze skupin uvedených v tabulce 1.4.
a ntiangiogenní léčba
Zasahuje do procesu novotvorby cév, které jsou nutné pro zásobení rostoucího nádoru živinami, a zejména kyslíkem. Léčiva této skupiny mohou zasahovat do aktivity receptoru pro vaskulární endoteliální růstový faktor (VEGF – vascular endothelial growth factor), jako např. lenvatinib (inhibitor tyrosinkinázové aktivity intracelu-
lární části receptoru pro VEGF) v léčbě recidivujícího karcinomu endometria nebo interagovat přímo s VEGF a bránit jeho vazbě na receptor, např. bevacizumab (monoklonální protilátka vázající se na VEGF) v léčbě karcinomu ovaria.
i nhibice parp
Proteiny rodiny PARP (poly-ADP-ribózapolymerázy), především PARP1, hrají významnou roli v opravě jednovláknových zlomů DNA mechanismem nahrazování jednotlivých bází (base excision repair). Pokud dojde k inhibici funkce těchto proteinů, hromadí se v nádorové buňce chyby v DNA při jejím dělení, což (často v kombinaci s dalšími protinádorovými látkami) vede k zániku nádorové buňky. Jsou využívány zejména u nositelek mutací (germinálních nebo somatických) genů BRCA1
a BRCA2, nacházejí však uplatnění i u dalších skupin pacientek. V onkogynekologii jsou aktuálně používány dvě látky – olaparib a niraparib. Jedná se o léčivé látky s menší molekulou podávané perorálně.
Checkpoint inhibitory
Použité látky spadají pod obecný pojem imunoterapie. Jedná se o velké molekuly (monoklonální protilátky) interagující s receptory, v současné době nejčastěji PD1 (programmed death 1) na povrchu T lymfocytů nebo ligandy těchto receptorů, v současné době nejčastěji PDL1 (ligand PD1) tvořený nádorovými buňkami, které působí útlum protinádorové imunitní odpovědi. Vyřazením mechanismu útlumu protinádorového působení příslušných buněk imunitního systému je podpořeno protinádorové působení imunity konkrétní pacientky (jedná se tedy o inhibici inhibice).
Mezi látky používané již v klinické praxi nebo ve vyšších fázích klinických studií patří pembrolizumab (protilátka proti PD1), dostarlimab (protilátka proti PD1), atezolizumab (protilátka proti PD-L1), durvalumab (protilátka proti PD-L1).
h ormonoterapie
V praxi se využívá jak podání gestagenů (medroxyprogesteron nebo megestrol), tak užití antiestrogenní léčby (nejčastěji tamoxifen nebo letrozol).
U nádorů vycházejících z endometria se primárně v rámci hormonální léčby používá podání vyšších dávek gestagenů. U nádorů z dalších částí mülleriánského systému lze použít v první volbě inhibitor aromatázy (nejčastěji letrozol), zejména u ovariálního karcinomu a nádoru z buněk granulózy, v dalších liniích event. modulátor estrogenních receptorů (tamoxifen) (tab. 1.5).
1.4.3 radioterapie
Radioterapie je metodou léčby ionizujícím zářením. Ať jsou nosičem záření urychlené elektrony (fotony) nebo protony, principem zůstává dopravení požadované energie do definovaného objemu tkáně. Jedná se o metodu léčby, která cílí pouze na určenou oblast (oproti léčbě systémové). Více informací viz kap. 5 Radioterapie.
Můžeme rozlišit některé formy radioterapie dle formy aplikace nebo indikace:
• Zevní radioterapie (teleradioterapie) – zevní ozařování, zdroj záření je mimo tělo pacientky, paprsek prochází přes povrch těla.
tabulka 1.5 Léčivé látky používané pro hormonální terapii v onko gynekologii
léčivá látka Mechanismus působení Nejčastější indikace medroxyprogesteron acetát gestagen karcinom endometria
megestrol gestagen karcinom endometria tamoxifen antiestrogen / selektivní modulátor estrogenních receptorů
karcinom prsu, karcinom ovaria, karcinom endometria
letrozol inhibitor aromatázy karcinom prsu, karcinom ovaria, nádor z buněk granulózy
• Vnitřní radioterapie (brachyradioterapie, brachyterapie) – do dutiny, v onkogynekologii nejčastěji do pochvy a kanálu děložního hrdla a děložní dutiny, je zaveden aplikátor, do něj poté pruty se zdrojem záření (afterloading), nejčastěji s iridiovými zrny. Dosah zářiče je v milimetrech až centimetrech. Je tak možné dopravit vyšší dávku s výrazně menším zatížením rizikových orgánů.
• Intersticiální radioterapie – forma brachyterapie, kdy jsou aplikátory zaváděny přímo do nádoru, poté je zaveden zářič (nejčastěji iridiová zrna).
• Konkomitance – k radioterapii je zpravidla jednou týdně přidána malá dávka chemoterapie s cílem potencovat účinek radioterapie (využíváno u karcinomu děložního hrdla, v některých centrech u karcinomu děložního těla).
• Radikální (primární, kurativní) radioterapie – léčba, jejímž cílem je pacientku vyléčit.
• Paliativní radioterapie – má za cíl zmírnění příznaků onemocnění, nevede k dlouhodobé kontrole onemocnění.
• Analgetická radioterapie – má za cíl zmírnění bolesti v místě přítomnosti nádoru (např. kostní metastázy, měkkotkáňové metastázy v pánvi, v břišní nebo hrudní stěně.
• Hemostyptická radioterapie – má za cíl zmírnění/zastavení krvácení, v onkogynekologii nejčastěji u karcinomu děložního hrdla nebo endometria.
2 eP idemi O lO gie gynek O lO gických nád O rů
a O rgani ZO vaný S creening
o ndřej Májek, o ndřej Ngo, Denisa k rejčí, Vladimír Dvořák, l adislav Dušek
Úvod
Epidemiologie představuje studium faktorů, které určují výskyt a rozdělení onemocnění v populaci. Tím se stává klíčovým nástrojem úzce provázaných oborů preventivní medicíny a veřejného zdravotnictví. Zatímco preventivní medicína se zaměřuje na zlepšování životů jednotlivců tím, že jim pomáhá zlepšovat jejich vlastní zdraví, veřejné zdravotnictví usiluje o podporu zdraví populací využitím organizovaných preventivních programů. Tradičně rozeznáváme primární prevenci, která brání rozvoji patologického procesu eliminací příčin nemoci nebo zvyšováním odolnosti proti nemoci, sekundární prevenci, která usiluje o přerušení patologického procesu, než se stane symptomatickým či pokročilým, a terciární prevenci, která omezuje fyzické a sociální následky symptomatické choroby (Katz, 2014).
V této kapitole se nejprve seznámíme s principy screeningu, který představuje klíčový nástroj sekundární prevence nádorových onemocnění. Právě screening karcinomu děložního hrdla je již dlouhá desetiletí široce rozšířeným a funkčním nástrojem, který snižuje nemocnost a úmrtnost na karcinom děložního hrdla. Tím screening velmi pozitivně ovlivňuje populační zátěž tímto onemocněním, které globálně bohužel stále patří mezi nejčastější nádorové příčiny úmrtí, zejména u mladých žen (Ferlay, 2020). Druhá část kapitoly tedy představí organizaci a výsledky tohoto screeningového programu v ČR. Třetí část kapitoly popíše zátěž české populace žen gynekologickými nádory, zmíněna bude i epidemiologie karcinomu prsu a související, rovněž již desítky let fungující, mamografický screeningový program.
2.1 o b EC ně o s C r EE nin G u zhoubnýC h ná D orů
z ákla D ní fakta
• Cílem zdravotního screeningu je snížit úmrtnost nebo nemocnost na nádorové onemocnění díky včasnějšímu záchytu v bezpříznakovém období.
• Systematický screening nepředstavuje jen samotný screeningový test, ale komplexní program se systémem zajištění kvality.
• Kromě významných přínosů pro jedince i celou společnost může screening přinášet i náklady a rizika, např. falešně pozitivní výsledky, nadbytečné diagnózy (overdiagnosis) a další.
• Aby mohly být doporučeny a zavedeny, musí screeningové programy v daném kontextu naplnit definovaná kritéria týkající se závažnosti cílového onemocnění, přesnosti screeningového testu, převahy přínosů nad riziky, nákladové efektivity apod.
2.1.1 Cíle a typy screeningu
Cílem zdravotního screeningu je obecně rozpoznat zdánlivě zdravé jedince, kteří však mají vyšší riziko zdravotního problému a kterým je tak možné nabídnout včasnou léčbu nebo jinou intervenci, což alespoň pro některé z nich může vést k lepším zdravotním výsledkům. Cíle konkrétního screeningového programu mohou zahrnovat snižování mortality nebo incidence onemocnění, případně snížení jeho závažnosti. Potenciálním cílem screeningu může být i poskytnutí informací pro další rozhodnutí (WHO, 2020).
Systematický screening představuje komplexní program, nikoliv jen samotný screeningový test. Takový program by měl zahrnout celou posloupnost kroků nezbytných ke snížení individuálního rizika nežádoucího zdravotního stavu, měl by být založen na spolehlivých vědeckých poznatcích a poskytován ve vysoké kvalitě
(Raffle, 2019). Mezi součásti screeningového programu obecně řadíme:
• identifikace populace způsobilé pro screening
• zvaní a informování způsobilých jedinců
• provedení screeningového testu
• směřování jedinců s pozitivním výsledkem screeningového testu na doplňující vyšetření, informování jedinců s negativním výsledkem screeningového testu
• diagnostika prostřednictvím doplňujících vyšetření
• intervence, léčba a dlouhodobé sledování
• sběr a analýza dat o screeningu, zpravodajství o výsledcích screeningu, průběžné zlepšování účinnosti a nákladové efektivity programu
Rozvoj zdravotnických technologií postupně v různé míře umožňuje personalizaci screeningových programů.
Systematický screening může mít s ohledem na stanovení cílové skupiny či formy screeningu tyto formy (SAPEA, 2022):
• Populační screening. Cílová populace je definována pouze na základě věku a pohlaví, např. screening karcinomu prsu určený všem ženám od 45 let.
• Cílený screening. Nabízený skupině osob identifikované na základě zvýšeného rizika onemocnění z důvodů faktorů životního stylu, genetické varianty, jiného onemocnění apod., např. cílený screening nádorů plic u těžkých bývalých nebo současných kuřáků.
• Stratifikovaný screening. Typ screeningu, screeningový test, intenzita screeningu se může měnit na základě individuálně stanoveného rizika, např. prodloužení screeningového intervalu dle výsledků HPV testu, podstoupeného očkování apod.
S ohledem na úroveň organizace screeningu pak můžeme rozeznávat (Ponti, 2017):
• Screeningový program. Měla by existovat strategie programu formulovaná v zákoně nebo oficiálním nařízení, rozhodnutí, směrnici nebo doporučení. Strategie specifikuje alespoň screeningový test, screeningový interval a skupinu způsobilých osob. Screening by měl být financován z veřejných zdrojů. Screening mimo screeningový program se nazývá oportunní (šedý) screening.
• Organizovaný screeningový program. Vyžaduje tým na národní nebo regionální úrovni zodpovědný za implementaci programu, tj. koordinaci poskytování služeb, zajištění kvality, sledování výkonnosti a výsledků, jsou vytvářeny komplexní doporučené postupy. Navíc je nezbytná struktura pro zajištění kvality a sledování populační zátěže sledovaným onemocněním.
• Populační screeningový program. Osoby ve způsobilé cílové populaci jsou individuálně identifikovány a pozvány ke screeningu. Některé programy omezují pozvání na osoby, které v recentním období nepodstoupily screeningový test. To je i případ českého programu screeningu karcinomu děložního hrdla.
2.1.2 princip screeningového programu
Od okamžiku manifestace nádoru klinickými příznaky začíná tzv. klinická fáze onemocnění. Již dříve je však možno zhoubný nádor nebo jeho prekancerózu odhalit screeningovým testem (cytologicky, metodami molekulární genetiky, biochemickými nebo zobrazovacími vyšetřeními). Tato část klinicky latentní (preklinické) fáze přirozeného průběhu onemocnění se nazývá diagnostické okénko screeningu nebo detekovatelná preklinická fáze ( detectable preclinical phase, sojourn time ). Období mezi odhalením nádoru screeningovým testem a jeho hypotetickou klinickou manifestací se nazývá interval výhody (lead time). Čím delší interval výhody (jedná se o specifickou hodnotu každého nálezu, jeho teoretické statistické rozdělení v populaci je však důležitým ukazatelem účinnosti programu), tím více se urychluje zahájení léčby. Klinicky latentní nádor lze často považovat za dobře léčitelné lokalizované onemocnění.
Screeningový test poskytuje teoreticky dva možné výsledky: pozitivní nebo negativní (moderní screeningové testy mohou poskytovat i škálu výsledků pro bližší stratifikaci, pro vysvětlení principů však předpokládejme tyto dva). Pozitivní výsledek testu je indikací k dalšímu vyšetření osoby pro upřesnění nebo vyloučení diagnózy, negativní výsledek znamená nepřítomnost choroby. Je jasné, že v obou případech se test může zmýlit. Kvalitní test poskytuje maximum pozitivních výsledků v populaci osob trpících hledaným onemocněním, a naopak maximum negativních výsledků ve zdravé populaci. Pravděpodobnost pozitivního výsledku u nemocné osoby se nazývá senzitivita testu. Pravděpodobnost negativního výsledku u zdravé osoby se nazývá specificita testu.
Přesnost screeningového testu nelze posoudit izolovaně jen podle senzitivity nebo specificity. Obě veličiny spolu úzce souvisejí a nelze maximalizovat obě najednou. U kvantitativních testů má rozhodující roli tzv. diagnostický práh – při jeho překročení (např. u biochemických markerů, koncentrace hemoglobinu ve stolici) je test hodnocen jako pozitivní. Příliš nízký práh pak bude znamenat zvýšené riziko falešně pozitivního testu, a tedy sníženou specificitu, na druhou stranu se však sníží počet falešně negativních výsledků a stoupne senzitivita.
VyŠetřeNí V Roce 2020
n = 2 121 720 žen
vč. 3156 jiné / neuvedeno / nelze diagnostikovat
bez neoplastických intraepiteliálních změn a malignity
2 063 236
ostatní maligní nádory / 6
adenokarcinom invazivní / 33
adenokarcinom in situ / 20
atypie žlázových buněk (spíše neoplastické) / 108
dlaždicobuněčný karcinom / 92
HSil – nelze vyloučit invazi / 136
atypie žlázových buněk / 5054
HSil / 2185
lSil / 15 752
aSc-H / 4338
aSc-uS / 27 604
obr. 2.3 Zastoupení výsledků screeningové cytologie (ženy podstupující screeningovou cytologii v roce 2020), zdroj dat IBA LF MU
ScReeNiNgoVá cytologie vybrané výsledky
%
8. atypie žlázových buněk
9. atypie žlázových buněk – spíše neoplastické
VyŠetřeNí V Roce 2020
počet, podíl známých výsledků
n = 983 (4 %)
n = 1026 (24 %)
n = 1395 (9 %)
n = 956 (44 %)
n = 45 (33 %)
n = 28 (30 %)
n = 233 (5 %)
n = 42 (39 %)
obr. 2.4 Korelace cytologických a histologických výsledků (screeningová vyšetření v roce 2020), zdroj dat IBA LF MU
4 c hem O tera P ie v léč B ě gynek O lO gických Z h O u B ných
nád O rů
Michal Zikán
Úvod
Chemoterapie je systémová léčba, je tedy podávána systémově – v naprosté většině případů v onkogynekologii intravenózně, vzácně intraperitoneálně nebo intratorakálně. Představuje podání cytotoxických látek, tedy látek, které zasahují do dělení a metabolismu metabolicky aktivních buněk (tab. 4.1). Nepostihuje pouze nádorové buňky, ale všechny buňky, které jsou metabolicky aktivní a rychle se dělí. Z toho plyne většina jejích nežádoucích účinků.
4.1 i n D ikaCE použití
C h E mot E rapi E
• Neoadjuvantní léčba je podávána s cílem zmenšit nádor a umožnit operační řešení (u pokročilých nádorů), nebo dovolit omezit radikalitu operačního výkonu (např. operace zachovávající fertilitu).
• Adjuvantní léčba je podávána jako zajišťovací po provedení jiné modality léčby, nejčastěji po operačním výkonu. Cílem léčby je zlikvidovat případné zbytkové onemocnění a snížit riziko recidivy onemocnění.
tabulka 4.1 Dělení cytostatik podle dominantního mechanismu účinku
Dělení cytostatik podle mechanismu účinku Podskupiny podle mechanismu účinku Nejčastěji užívaná cytostatika v onkogynekologii
Inhibice biosyntézy NK
1. blok syntézy nukleových kyselin přímou inhibicí enzymu
2. inkorporace do DNA místo přirozeného metabolitu
poškození struktury a funkce již přítomných NK (alkylace, interkalace, rozštěpení DNA)
inhibitor topoizomerázy I (brání rozpletení dvojitého vlákna DNA)
inhibitor topoizomerázy II
antimetabolity (falešně prekurzory tvorby NK a bílkovin)
alkylační látky (kovalentní vazba mezi vlákny DNA)
• kamptotecinová analoga (topotekan, irinotekan)
• deriváty epipodofylotoxinu (etoposid), taxany, antracyklinová antibiotika (doxorubicin, epirubicin aj.) a antracenoidy (mitoxantron)
• antifolika (methotrexát)
• pyrimidinové antimetabolity (5 fluorouracil, gemcitabin)
• ozafosfariny (cyklofosfamid, ifosfamid) platinová cytostatika (reakce s DNA vede k rozštěpení, popř. k pevnému spojení dvou řetězců nebo i dvou samostatných molekul DNA)
interkalační látky (cytostatická antibiotika produkovaná bakteriemi rodu Streptomyces), (nekovalentní vazba mezi páry bází DNA)
rostlinné alkaloidy (brání tvorbě mikrotubulů)
• karboplatina (CBDCA) cisplatina (cDDP)
• oxaliplatina
• antracyklinová antibiotika a antracenoidy
• mitomycin C
• aktinomycin D bleomycin blok mitózy (poškození mikrotubulů a zábrana buněčného dělení)
• vinkristin vinorelbin taxany (brání degradaci mikrotubulů jejich stabilizací)
• paklitaxel
• docetaxel poškození buněčné membrány cytostatická antibiotika
• antracykliny, antracenoidy, aktinomycin D, bleomycin
• Konkomitantní léčba je podávána současně s radioterapií, zpravidla je podávána nižší dávka chemoterapeutika k potenciaci účinku radioterapie.
• Kurativní léčba je podávána s cílem poskytnout pacientce nejlepší možnou šanci na úplné vyléčení. Adjuvantní chemoterapie je nejčastěji léčbou kurativní.
• Paliativní léčba je podávána s cílem zmírnit příznaky onemocnění, zlepšit kvalitu života, event. prodloužit interval do progrese onemocnění. V této indikaci není chemoterapie podávána s cílem pacientku vyléčit.
4.2 p o D mínky pro po Dání
C h E mot E rapi E
Základní podmínkou je, že pacientka má z léčby profitovat – ať již zvýšením šance na úplné vyléčení, prodloužením života, zlepšením kvality života nebo zmenšením obtíží způsobených nádorem. Vždy je nutné vážit prospěch podání léčby vůči jejím nežádoucím účinkům, a to jak před zahájením léčby, tak v jejím průběhu. V případě nemožnosti zvládnout nežádoucí účinky léčby je třeba dávku redukovat, přejít na jiný preparát nebo jinou kombinaci, příp. léčbu ukončit.
Paliativní péče (po vyčerpání možností aktivní léčby) může v mnoha případech přinést významnější zlepšení kvality života než pokračování v aktivní léčbě (chemoterapii) za každou cenu. Některé práce považují za negativní ukazatel kvality paliativní léčby onkologického pacienta, pokud byl v období tří měsíců před smrtí léčen chemoterapií. Rozhodnutí o ukončení aktivní léčby je nesmírně obtížné a musí být vždy učiněno pacientkou po podrobné diskusi na základě doporučení kvalifikovaného multidisciplinárního týmu. Pacientce musí být zároveň poskytnuta možnost využít kvalifikované následné paliativní péče (hospic, domácí hospic, oddělení paliativní péče).
Celkový stav pacientky (její výkonnost – performance status) je nejčastěji hodnocen podle systému ECOG PS (Eastern Cooperative Oncology Group Performance Status) převzatého WHO (tab. 4.2).
Ambulantně podáváme chemoterapii zpravidla u pacientek s PS 0–2, u PS 3 s ohledem na předpokládaný efekt na zlepšení kvality života (např. neoadjuvantní podání u karcinomu vaječníků).
Laboratorně je hodnocen stav důležitých orgánových systémů.
tabulka 4.2 Hodnocení celkového stavu pacientky podle systému
ECOG PS
Stupeň Hodnocení
0 plně aktivní, je schopna všech běžných aktivit bez omezení
1 omezení fyzicky náročných aktivit, ambulantní, schopna lehčí práce (domácí práce, kancelářská práce)
2 ambulantní, schopna péče o sebe, ale neschopna jakékoli práce; mimo lůžko více než 50 % denní doby
3 schopna omezené péče o sebe, upoutána na lůžko více než 50 % denní doby
4 neschopna jakékoli činnosti, neschopna péče o sebe, upoutána na lůžko nebo do křesla
5 mrtvá
tabulka 4.3 Požadavek na minimální hodnoty krevního obrazu před podáním chemoterapie
Parametr jednotky
hemoglobin
leukocyty
100 g/l
3 × 109/l
absolutní počet neutrofilů 1,5 × 109/l
trombocyty
k revní obraz
100 × 109/l
Pro podání chemoterapie jsou vyžadovány minimální hodnoty (tab. 4.3).
• Hemoglobin 100 g/l (při dobrém klinickém stavu pacientky a nízké hematotoxicitě podávané chemoterapie lze tolerovat i hodnoty mezi 90 a 100 g/l).
• Leukocyty 3×109/l (důležitější hodnotou, než je celkový počet bílých krvinek, je absolutní počet neutrofilů).
• Absolutní počet neutrofilů (APN; ANC – absolute neutrophil count) 1,5×109/l (při příznivém počtu neutrofilů lze tolerovat nižší hodnotu celkových leukocytů).
• Trombocyty 100×109/l.
j aterní funkce
Posuzována je metabolická i exkreční funkce jater. Hodnoty nejčastěji sledovaných enzymů (ALT, AST, GGT) by měly být v referenčních mezích dané laboratoře, samozřejmě s přihlédnutím ke způsobu exkrece daného použitého cytostatika (např. paklitaxel je z největší části metabolizován a vylučován játry) nebo s ohledem na případné metastatické postižení jater (kdy očekáváme
vyšší hodnoty transamináz). V klinických studiích je často používán tzv. Hyův zákon (Hy’s law), soubor jednoduchých indikátorů případného toxického postižení jater. Kombinuje elevaci transamináz a elevaci bilirubinu – vzestup těchto hodnot signalizuje hrozící hepatální selhání.
r enální funkce
U nefrotoxických léčivých látek (v gynekologii se týká především cisplatiny a karboplatiny) je před zahájením léčby a v jejím průběhu kontrolována hladina kreatininu. V případě hraničních hodnot nebo u pacientek se známou poruchou ledvinných funkcí může být vyšetřena i clearance kreatininu ze sbírané moči. Požadované hodnoty by se měly pohybovat ve fyziologickém rozmezí pro dané pohlaví a věk. V případě trvale chronicky snížené funkce ledvin (většinou v důsledku nesouvisejícího chronického onemocnění) lze dle závažnosti situace snížit dávku léčiva, příp. použít látku nebo kombinaci, která neovlivňuje renální funkce.
Časnou fázi glomerulárního poškození je možné detekovat pomocí vyšetření sérové hladiny cystatinu C. Jedná se o malou bílkovinu, jejíž syntéza je stabilní, není ovlivněna katabolismem, dietou ani zánětem. Vzestup plasmatické hladiny cystatinu C tak může časně signalizovat riziko renálního selhání.
s pecifické systémy dle toxicity použitých látek
V léčbě gynekologických nádorů se jedná především o použití kardiotoxických režimů (antracyklinová antibiotika – doxorubicin, epirubicin, lipozomální doxorubicin; ale kardiotoxicita byla popsána i u cisplatiny). Echokardiografické vyšetření pacientka absolvuje před zahájení chemoterapie, po 3. cyklu léčby a při ukončení léčby. Hodnocena je ejekční frakce levé komory, která by měla být minimálně 55 %. Elektrokardiogram je hodnocen před každým podáním chemoterapie. Důsledkem kardiotoxického působení chemoterapie mohou být poruchy rytmu nebo dilatační kardiomyopatie.
U bleomycinu je popisována pneumotoxocita, proto vyžadujeme před zahájením chemoterapie provedení spirometrie. Dalším nežádoucím účinkem bleomycinu může být výskyt hyperpigmentovaných pruhů na kůži, především na trupu (syndrom bičování).
r elativní dávková intenzita
Dodržení plánovaného schématu léčby ve smyslu dodržení dávky a intervalu podání může být hodnoceno parametrem relativní dávkové intenzity (RDI). Intenzita dávky se nejčastěji vyjadřuje v mg/m2/týden, relativní intenzita (v procentech) je pak poměrem mezi dosaženou (skutečnou) a plánovanou intenzitou dávky.
4.3 l átky použí Vané V léčbě G
yn E kolo G i C kýC h zhoubnýC h ná D orů
4.3.1 platinové deriváty
Řadí se mezi látky poškozující strukturu DNA, jsou blízké alkylačním látkám. Obě níže uvedené látky lze podat jak nitrožilně (i.v.), tak intraperitoneálně (i.p.). Jsou součástí většiny režimů používaných u gynekologických zhoubných nádorů.
Cisplatina
Cisplatina (cDDP – cis-diamindichlorplatina) se používá se od začátku 70. let. Podává se ředěná ve fyziologickém nebo Ringerově roztoku. Roztok je citlivý ke světlu (vlivem světla dochází k přeměně cisplatiny na transizomer, který nemá protinádorovou účinnost, ale je silně mutagenní). Používá se jak v monoterapii, tak v kombinacích. Je využívána i k potenciaci účinku radioterapie (v onkogynekologii v léčbě karcinomu děložního hrdla).
Nejzávažnějším nežádoucím účinkem je poškození renálních tubulů – nefrotoxicita. Riziko nefrotoxicity lze významně snížit vhodným hydratačním režimem – podáním 500–1000 ml 5% roztoku glukózy po dobu 1–2 hodin před aplikací cisplatiny, podáním infuze manitolu k navození forsírované diurézy a následně další hydratací cca 500 ml fyziologického roztoku i.v.
Nevolnost a zvracení se vyskytuje u téměř všech pacientek po podání cisplatiny. K její profylaxi a léčbě se kromě setronů používá i antagonista neurokininu 1 aprepitant v kombinaci s kortikoidy. Vzácně se vyskytuje i ototoxicita a hypomagnezemie.
k arboplatina
Karboplatina (CBDCA – součástí molekuly je cyklobutandikarboxylová kyselina) patří k platinovým derivátům druhé generace, ve srovnání s cisplatinou je stabilnější, pomalejšímu uvolňování aktivních skupin z komplexu se přisuzuje nižší nefrotoxicita. Ve srovnání s cisplatinou má však vyšší hematotoxicitu projevující se především trombocytopenií. Spektrum protinádorové účinnosti se u cisplatiny a karboplatiny do značné míry překrývá, lze je tedy často, především u karcinomu ovaria, zaměnit s ohledem na toxicitu vyjádřenou u konkrétní pacientky. Karboplatina je rychle vylučována ledvinami. Dávkuje se podle glomerulární filtrace (vypočtená clearance podle Cockcroftova-Gaultova vzorce na základě změřené hodnoty kreatininu, nebo změřená na základě sběru moči) a plochy pod křivkou (AUC – area under
curve) plasmatické koncentrace karboplatiny. Požadovaná dávka je vyjádřena násobkem AUC, u 3týdenních režimů zpravidla AUC 5–7, u týdenních režimů AUC 2. Alergická reakce na podání karboplatiny není výjimečná, lze ji však předejít podáním kortikoidů v premedikaci, nebo utlumit použitím tzv. desenzitizace v dalším cyklu po alergické reakci.
Cyklofosfamid
Je používán od konce 50. let 20. století. V původní formě je neaktivní, aktivní metabolity vznikají až zpracováním v játrech. Má také účinky imunosupresivní. Vylučuje se převážně do moči. Proniká placentární bariérou a je také vylučován do mateřského mléka. Podává se v kombinaci, výjimečně v monoterapii paliativně v perorální formě u karcinomu ovaria. Nežádoucí účinky jsou mírné, patří mezi ně nevolnost, zvracení a alopecie. Při vysokých dávkách (nad 1 g) je urotoxický.
4.3.2 taxany
Patří mezi mitotické jedy. Působí proti mikrotubulům, především mitotického vřeténka. Mikrotubuly jsou nutné pro migraci chromozómů k pólům dělící se buňky, udržení tvaru buňky, buněčnou mobilitu a přenos signálu z membrány do jádra. Lze je kromě intravenózního podání podat i intraperitoneálně. Původně byly získávány z tisu.
paklitaxel
Paklitaxel (PTX) je metabolizován v játrech a vylučován do žluči. Proniká do ascitické tekutiny a pomalu se z ní eliminuje, což může být výhodou při podání u pokročilého nebo recidivujícího karcinomu vaječníků. Hlavním nežádoucím účinkem je hematotoxicita projevující se především granulocytopenií. Standardně se vzhledem k vyššímu riziku alergické reakce před podáním paklitaxelu aplikuje premedikace kortikoidy. Častým projevem nežádoucí reakce je periferní neuropatie, která se projevuje necitlivostí nebo paresteziemi chodidel a prstů rukou i nohou. Lze jej podávat ve 3týdenním i týdenním režimu. Ve 3týdenním režimu je dominantním nežádoucím účinkem granulocytopenie (zejména v kombinovaném režimu s platinovým derivátem) a periferní neuropatie, při týdenním podání je riziko periferní neuropatie výrazně nižší, ale dominuje výskyt onychopatie.
Docetaxel
Spektrum účinnost je velmi podobné paklitaxelu. Vzhledem k nižší neurotoxicitě ve srovnání s paklitaxelem může být docetaxel použit především u pacientek s ovariálním karcinomem v kombinaci místo paklitaxelu. He-
matologická toxicita je stejná. Častá je také retence tekutin. Hypersenzitivní reakce je však výrazně méně častá.
4.3.3 antracyklinová antibiotika
Antracykliny působí několika mechanismy: přímou interkalací (vmezeřením) do struktury DNA, účinkem na topoizomerázy a tvorbou volných kyslíkových radikálů. Poslední mechanismus je odpovědný také za kardiotoxicitu antracyklinů. Pro antracykliny existuje celková celoživotní kumulativní dávka, tedy maximální dávka, kterou může pacientka obdržet za celý život.
Doxorubicin
Vylučuje se převážně játry, při poruše jaterní funkce je třeba redukovat dávku na polovinu. Celková celoživotní kumulativní dávka je 550 mg/m2. Nejčastějším nežádoucím účinkem je hematotoxicita a kardiotoxicita. Častá je také mukozitida, kožní pigmentace nebo pigmentace nehtů.
l ipozomální doxorubicin a pegylovaný lipozomální doxorubicin
Enkapsulace doxorubicinu do lipozomů veden k výraznému snížení jeho toxicity. Kumulativní dávka se pohybuje kolem 1260 mg/m2. Lipozomální částice obalená methoxypolyethylenglykolem (pegylace) snižuje clearance lipozomálního doxorubicinu a prodlužuje jeho biologický poločas. Takto připravené partikule pronikají defektní stěnou nádorových cév, zdravou stěnou nenádorové cévy však pronikají minimálně. To vede k výrazně nižší toxicitě takto upraveného doxorubicinu. Mezi nežádoucími účinky dominuje tzv. hand-foot syndrom – suchost, zarudnutí a odlupování kůže na ploskách a dlaních a mukozitida.
Epirubicin
Má kratší poločas než doxorubicin. Kumulativní dávka epirubicinu je 1080 mg/m2. Nejčastějším nežádoucím účinkem je leukopenie a trombocytopenie. Ostatní nežádoucí účinky jsou méně časté než u doxorubicinu.
4.3.4 inhibitory topoizomeráz
topotekan
Inhibuje topoizomerázu I, enzym nutný pro zpřístupnění DNA transkripčnímu aparátu. Vylučuje se převážně ledvinami. Může být podáván ve 3týdenním i týdenním režimu, který má v některých případech nižší hematotoxicitu. Mezi nežádoucími účinky dominuje granulocytopenie. Časté jsou průjmy, nauzea a zvracení se objevují asi jenom u pětiny pacientek, málo častá je i alopecie.
tabulka 4.16 Složení a dávkování antiemetické profylaxe u vysoce emetogenní chemoterapie
léčivá látka akutní fáze (den 1) opožděná fáze
inhibitor 5 HT3 (setron) ondansetron 16–24 mg p.o. nebo 8–16 mg i.v. nebo granisetron 2 mg p.o. nebo 1 mg i.v. nebo palonosetron 0,25 mg i.v. nebo 0,5 mg p.o. 0
+ inhibitor NK1 aprepitant 125 mg p.o. nebo netupitant 300 mg aprepitant 80 mg p.o. dny 2–3
+ kortikoid dexamethason 12 mg p.o. nebo i.v. 8 mg p.o. nebo i.v. dny 2–4
+ olanzapin 5–10 mg p.o. 5–10 mg p.o. dny 2–4
+/− inhibitor receptoru H2 nebo inhibitor protonové pumpy
U středně emetogenní chemoterapie lze použít stejný režim jako výše, alternativou může být olanzapinový režim (i u vysoce emetogenní chemoterapie) s vyšší účinností v léčbě opožděného zvracení (tab. 4.17). Palonosetron je u těchto režimů upřednostňován pro vyšší účinnost proti opožděnému zvracení a nevolnosti.
U režimů s nízkou emetogenitou jsou omezené informace o antiemetické profylaxi. Je užívána profylaxe akutního zvracení jednou léčivou látkou.
léčba akutního nebo průlomového zvracení Léčba již vzniklé nevolnosti nebo zvracení je méně účinná než profylaxe. Problémem léčby může být nemožnost perorálního podání.
V léčbě akutního/průlomového zvracení jsou používány všechny výše uvedené léčivé látky (tab. 4.18).
Setrony (antagonisté 5-HT3) jsou účinnější než podání metoklopramidu. Jejich účinek se potencuje současným podáním s kortikoidy. Jejich perorální forma je stejně účinná jako intravenózní. Všechny léčivé látky první generace mají stejnou účinnost. Antiemetický efekt setronů má plateau, tedy další zvyšování doporučené dávky nemá smysl. Jednotlivá dávka má stejný efekt jako opakované podání menších dávek. Druhá generace setronů (palonosetron) má vyšší afinitu k receptorům 5-HT3 a delší poločas, v monoterapii je účinnější než první generace. Méně ovlivňuje interval QT (použití u kardiaků). V kombinaci s kortikoidy je však účinnost setronů stejná bez ohledu na generaci.
Časné i oddálené nauzey lze s vyšší účinností (u látek s vysokou emetogenitou) předcházet podáním inhibitoru NK1 – aprepitantu. U vysoce rizikových režimů
tabulka 4.17 Olanzapinový režim v antiemetické profylaxi u vysoce a středně emetogenní chemoterapie
léčivá látka jednotlivá dávka Doba podávání palonosetron 0,25 mg i.v. den 1
dexamethason 12 mg i.v. den 1
olanzapin 5–10 mg p. o. dny 1–4
tabulka 4.18 Léčba průlomového zvracení léčivá látka Dávka interval podání metoklopramid 10 mg i.v. v rychlé infuzi 3–4× denně ondansetron 8 mg i.v. nebo p.o. 8–12 h granisetron 1 mg i.v. nebo 2 mg p.o. jednorázově haloperidol 1–2 mg i.v. nebo p.o. 4–6 h
dexamethason 12 mg i.v. nebo p.o. 24 h promethazin 12,5–25 mg i.v. nebo infuze nebo p.o. 4–6 h
alprazolam 0,5–1 mg 6 h
olanzapin 5–10 mg/d po dobu 3 dnů 24 h
se využívá kombinace setronu, kortikoidu a aprepitantu, především u režimů s cisplatinou.
Kortikoidy (dexamethason) lze používat v monoterapii nebo v kombinaci, kdy se zvyšuje antiemetogenní účinek současně podávaného léčiva o 25 %.
Další léčivé látky ( metoklopramid, fenothiaziny, butyrofenony a kanabinoidy) mají nižší účinnost než kortikoidy, setrony a aprepitant. Jsou používány při intoleranci účinnějších léčivých látek nebo v kombinaci.
léčba odloženého zvracení
Odložené zvracení je nejčastější u kombinací s platinou. Premedikace podávaná před aplikací chemoterapie tento typ zvracení neovlivní. Doporučeno je pokračování v léčbě kortikoidy, event. v kombinaci s aprepitantem u závažnějších forem odloženého zvracení. Setrony nejsou v této indikaci dostatečně efektivní.
léčba anticipovaného zvracení
Anticipované zvracení se vyskytuje u pacientek, které mají zkušenost se zvracení z předchozích linií nebo cyklů chemoterapie, nebo mají zkušenost se zvracením v rámci jiných stavů (např. těhotenství). Hlavní prevencí je dostatečně účinná léčba akutního a oddáleného zvracení a nefarmakologické metody (autogenní trénink, hypnóza). Eventuálně je možné podat nízké dávky benzodiazepinů.
5 r adi O tera P ie
Zdeňka Pechačová, k arolína Votavová
5.1 Ú V o D
z ákla D ní fakta
• Radioterapie je léčba ionizujícím zářením
• Ionizující záření ničí nádorové buňky zejména poškozením DN a
• Dávka záření je aplikována většinou v dávce 2 Gy denně 5× týdně po dobu několika týdnů – normofrakcionace
• j iná schémata se užívají k zesílení biologického účinku dle charakteru nádorového růstu a záměru léčby.
• Nádorová hypoxie zvyšuje agresivitu nádoru a snižuje citlivost k ionizujícímu záření
Radioterapie představuje jednu ze základních modalit onkologické léčby, kdy je aplikováno ionizující záření za účelem léčby nádorového onemocnění. Ionizující záření je přenos energie v podobě částic nebo elektromagnetických vln vlnové délky do 100 nm, s frekvencí nad 3 × 1015 Hz, který je schopen přímo nebo nepřímo vytvářet ionty (ionizovat). Je emitováno při radioaktivním rozpadu – samovolné vnitřní přeměně složení nebo energetického stavu atomových jader. Základní jednotkou absorbované dávky záření v soustavě SI je 1 Gy (gray), což odpovídá energii záření 1 J (joule) absorbované v 1 kg látky. Cílem radioterapie je eliminace nádorových buněk za současného maximálního šetření okolních zdravých tkání k zajištění přijatelného rizika akutních a pozdních nežádoucích účinků léčby.
5.1.1 Vliv ionizujícího záření na tkáně
Radioterapie je využívána v léčbě nádorů od počátku 20. století a vývoj této metody je spjat s rozvojem radiobiologie – vědního oboru zkoumajícího vliv ionizujícího záření na tkáně. Na podkladě těchto výzkumů i zkušeností z praxe byla stanovena základní frakcionační schémata ozařování a byly vyvinuty radiobiologické modely popisující léčebné účinky a reakci zdravých tká-
ní. Znalost radiobiologických principů je nezbytná pro využívání moderních technik radioterapie zejména při aplikaci vyšších jednotlivých dávek ionizujícího záření (kontrahované režimy, stereotaktické ozáření) nebo pro aplikaci radioterapie v kombinaci s chemoterapií a dalšími modalitami onkologické léčby.
Interakce ionizujícího záření s buňkami tkání sestává z dějů fyzikálních (interakce s atomy tkání), chemických (vznik volných radikálů a poškození DNA) a biologických (zástava buněčného cyklu a oprava DNA). Buňky nádorových a zdravých tkání se liší ve schopnosti opravovat poškození nebo iniciovat apoptózu. Nádorové buňky mají menší schopnost reparace poškození, jsou tedy náchylnější ke vzniku chyb v genomu a k jejich kumulaci, čímž dochází k jejich zničení působením ionizujícího záření, zatímco zdravým tkáním je poskytnut prostor pro reparaci mezi frakcemi. Nádory i zdravé tkáně mají různou citlivost k působení ionizujícího záření – radiosenzitivita, radiorezistence
Biologický účinek ionizujícího záření závisí na vlast nostech ozařovaných tkání a na parametrech ozařovací série (velikost jednotlivé dávky, celková doba trvání léčby, počet frakcí, ozařovací technika, vlastnosti ozařovacího svazku atd.). Reakce zdravých tkání na ozáření je dána jejich proliferačním stavem a uspořádáním buněk ve funkčních kompartmentech. Buňky tkání s vysokou proliferační aktivitou (kůže, sliznice, hemopoetický systém) mají krátkou dobu buněčného cyklu i kratší čas na reparaci, proto zde dochází typicky ke vzniku akutní reakce na ozáření. Oproti tomu ve tkáních s nižším stupněm proliferace (mezenchymové tkáně – vazivo), kde mají buňky delší dobu trvání buněčného cyklu a vyšší stupeň reparace, se projevy toxicity manifestují až po nakumulování radiačního poškození a překročení kapacity reparačních mechanismů – dochází zde převážně k projevům pozdní toxicity. Reakce orgánů na záření je dána také uspořádáním funkčních podjednotek – sériové nebo paralelní uspořádání. Na základně popsaných vlastností jsou nastavena kritéria hodnocení ozařovacích plánů a parametry možného radiačního zatížení rizikových struktur tak, aby přínos z provedené léčby převažoval nad rizikem vzniku nežádoucích účinků.
5.1.4 způsoby aplikace radioterapie
z ákla D ní fakta
Radioterapie je k léčbě nádorů využívána se záměrem:
• kurativním
• neoadjuvantním
• adjuvantním
• profylaktickým
• paliativním
Radioterapie dle způsobu umístění zdroje:
• zevní radioterapie – zdroj záření je mimo tělo pacienta
• brachyterapie – zdroj umístěný přímo do rizikové oblasti
Léčba zářením je prováděna pomocí ozařovačů s přítomným radionuklidem (kobalt, iridium a další) nebo pomocí generátorů záření (urychlovače elektronů, těžkých částic, rentgenové přístroje), kde jsou urychlovány nabité částice a v důsledku dalšího sledu dějů je generováno ionizující záření. V současné době jsou pro zevní ozařování fotonovou radioterapií využívány zejména lineární urychlovače. Výhodou těchto přístrojů je možnost volby energie a modulace dalších parametrů svazku, čímž je dosaženo větší přesnosti doručení dávky. V indikovaných případech může být vhodné užití protonové radioterapie, která poskytuje odlišné radiobiologické a dozimetrické vlastnosti oproti fotonovému ozařování. Moderní technologie v radioterapii zajišťují přesnější ozáření cílových objemů za současného lepšího šetření zdravých tkání. Tak je sníženo riziko akutních i pozdních nežádoucích účinků s cílem zajistit pacientům uspokojivou kvalitu života po léčbě zářením.
Radioterapie je využívána v různých indikacích –s kurativním záměrem jako hlavní metoda léčby nádoru, dále se uplatňuje neoadjuvantní a adjuvantní přístup ke zlepšení léčebného přínosu chirurgické léčby nebo profylaktické ozáření v indikovaných případech. Důležitou skupinu indikací představuje paliativní ozáření ke zmírnění symptomů pokročilého nádorového onemocnění. Léčba zářením je využívána také v léčbě některých nenádorových stavů po selhání jiných léčebných metod: endokrinní orbitopatie (aplikace nízké dávky na lineárním urychlovači), artrózy, tendinitidy, fasciitidy (aplikace velmi nízkých dávek pomocí rentgenového ozařovače).
Podle způsobu aplikace a umístnění zdroje ionizujícího záření rozlišujeme zevní radioterapii, kde zdroj zůstává mimo tělo pacienta, a brachyterapii, při níž je zdroj umístěn přímo do rizikové oblasti.
5.2 z ákla D ní pojmy a DE fini CE
z ákla D ní fakta
Plánování radioterapie – na podkladě ct snímků, fúze s MR, PET/CT
Definice cílových objemů:
• gt V – rozsah tumoru dle zobrazovacích metod
• ct V – lem na mikroskopické šíření
• P t V – lem na pohyb orgánů nebo nepřesnosti nastavení polohy pacienta
• o aR – rizikové orgány v okolí
Fyzikální výpočet ozařovacího plánu:
• doručení předepsané dávky do cílového objemu
• šetření zdravých tkání – dodržení dávkových omezení na rizikové orgány
Plánování radioterapie je prováděno na podkladě nativních CT snímků, které poskytují údaje o elektronové denzitě a je možné je využít k určení dávkové distribuce. Vyšetření je provedeno v definované poloze, která je poté co nejpřesněji reprodukována před každou frakcí záření. Pro přesnější definici cílových objemů je využívána fúze snímků s nálezy dalších zobrazovacích metod – kontrastní CT, MR nebo pozitronová emisní tomografie (PET) v kombinaci s CT (PET/CT).
Radiační onkolog definuje ve snímcích cílové objemy – obr. 5.1:
• GTV (Gross Tumor Volume) – objem nádoru prokazatelně určený diagnostickými zobrazovacími metodami nebo klinickým vyšetřením.
• CTV (Clinical Target Volume) – anatomicko-klinický objem, který je definován jako GTV s lemem zahrnujícím oblast mikroskopického šíření nádoru a případně i se spádovými lymfatickými oblastmi. Při určování tohoto objemu jsou využívány doporučené postupy, je brána v úvahu invazivita tumoru a pravděpodobnost jeho šíření.
• PTV (Planning Target Volume) – geometrický pojem, který kompenzuje nepřesnosti způsobené pohybem a změnou velikosti jednotlivých orgánů nebo nepřesnosti při nastavení pacienta. Vychází z přístrojových možností daného pracoviště i z praktických zkušeností.
• OaR (organs at risk) – orgány a tkáně v okolí cílového objemu, jejichž radiosenzitivita musí být při plánování vzata v úvahu a může významně ovlivnit plánování léčby nebo předepsanou dávku na PTV.

obr. 5.1 Definice cílových objemů v radioterapii – transverzální řez. Oranžová – GTV (Gross Tumor Volume), růžová – CTV (Clinical Target Volume), červená – PTV (Planning Target Volume), další barvy – OaR (organs at risk) – orgány a tkáně v okolí cílového objemu


Radiologický fyzik poté provede fyzikální výpočet plánu na podkladě dávkového předpisu na PTV a dávkových omezení (dose constraints) na oblast OaR – obr. 5.2. Ozařovací plán je hodnocen z hlediska pokrytí cílového objemu předepsanou dávkou a vyhovujícího šetření rizikových orgánů. Je posuzováno rozložení izodóz (křivky spojující místa se stejnou dávkou) ve 3D zobrazení plánu a dávkově objemový histogram (DVH) poskytující odpovídající informaci v přehledné snadno interpretovatelné formě – viz obr. 5.2.
Dávková omezení na rizikové struktury jsou stanovena na podkladě radiobiologických výzkumů tak, aby bylo zajištěno přijatelné riziko nežádoucích účinků. Obvykle se jedná o riziko závažnějších forem pozdní toxicity < 5 %, ale u některých orgánů, jejichž poškození by kriticky narušilo kvalitu života (např. vznik míšní léze nebo výpadek optických drah), je limit mnohem přísnější. Pro orgány se sériovým uspořádáním funkčních podjednotek (např. mícha, chiasma opticum) je posuzována zejména maximální dávka, případně dávka v 1 % objemu nebo ve 3 mm3. U orgánů s paralelním uspořádáním funkčních

obr. 5.2 Ozařovací plán pro zevní radioterapii. Technika IMRT VMAT, transverzální a sagitální řez. Dose volume histogram (DVH) – zobrazení dávkové distribuce v oblasti cílových objemů a rizikových struktur. Izodózy: červená – 100 % předepsané dávky, oranžová – 95 % předepsané dávky, modrá –75 % předepsané dávky
podjednotek (plíce, játra) je posuzován spíše objem zatížený vyššími dávkami (např. oblast plíce zatížená dávkou > 20 Gy má být menší než 30 % plicní tkáně), ale malý okrsek zatížený vysokou dávkou je dobře akceptovatelný, protože eventuální poškození zde nenaruší funkci orgánu.
5.3 nE žá D ou C í Ú činky ra D iot E rapi E
z ákla D ní fakta
Při ozařování jsou v různé míře ovlivněny zdravé tkáně v okolí cílového objemu.
Nežádoucí účinky radioterapie dělíme na akutní (během léčby a do 3 měsíců po léčbě) a pozdní projevující se s odstupem měsíců nebo let.
a kutní toxicita:
• postiradiační syndrom – apatie, únava, bolesti hlavy, nechu tenství
• lokální dle ozařované oblasti – reakce kůže a sliznic
Pozdní toxicita:
• často ireparabilní , výrazně ovlivňuje kvalitu života
• vznik na podkladě fibroprodukce , změn v mikrovaskulatuře , působením inflamatorních cytokinů
• atrofie kůže, fibróza podkoží, suchost sliznic, stenózy, ulcerace, píštěle aj.
Radiační poškození zdravých tkání vede ke vzniku toxicity, která může výrazně ovlivnit kondici pacienta. Změnám ve zdravých tkáních se nelze při ozařování zcela vyhnout, neboť je často nezbytné zahrnout do cílových objemů i lem okolní zdravé tkáně z důvodu rizika šíření nádorových buněk do okolních tkání a velkou roli v zatížení okolních struktur hraje také rozptýlené záření. Radioterapie je tedy vždy spojena s jistým rizikem toxicity. Nežádoucí účinky jsou rozdělovány dle časového vztahu k provedení léčby na akutní, projevující se v průběhu léčby a do tří měsíců po léčbě, a pozdní, které se rozvíjejí v odstupu měsíců nebo let po léčbě.
5.3.1 akutní toxicita
Akutní toxicita se během léčby může projevit ve formě tzv. postiradiačního syndromu – jedná se o ne zcela jasně definovaný soubor subjektivních (apatie, únava, bolesti hlavy, nechutenství, nevolnosti) a objektivních
(odchylky hladin krevního obrazu) změn. Etiologie je komplexní na podkladě účinku ionizujícího záření na organismus, roli hraje uvolnění katabolitů po rozpadu buněk nebo psychický stav pacienta. Toxicita radioterapie se dále projevuje typickými nežádoucími účinky dle ozařované lokality – poruchy krvetvorby, alopecie, mukozitida, radiodermatitida, nevolnosti, polakisurie, dysurie, průjmy a další. Tyto projevy lze zmírňovat vhodnou podpůrnou léčbou.
5.3.2 pozdní toxicita
Pozdní toxicita po radioterapii představuje zásadní komplikaci léčby. Jedná se o ireparabilní změny a je důležité minimalizovat riziko jejich vzniku při plánování radioterapie. Projevy vznikají na podkladě poruch pojivové tkáně (fibroprodukce), změn v mikrovaskularizaci, působením inflamatorních cytokinů a dalšími mechanismy. Rozvoj pozdních nežádoucích účinků je ovlivněn velikostí ozařovaného objemu, aplikovanou dávkou i faktory souvisejícími s multimodální léčbou – kombinace s pooperačními změnami nebo akcentace změn při konkomitantní chemoterapii. Jedná se o atrofii kůže, fibrózu podkoží a další fibrotické změny v ozářeném objemu, suchost sliznic, sterilitu, předčasnou menopauzu, svráštění močového měchýře, radionekrózu (centrální nervová soustava – CNS, skelet), chronickou proktitidu, stenózy, ulcerace, píštěle, kognitivní deficit po ozáření CNS (zejména některých oblastí – hippocampus), neuropatie, osteoporózu a další. Během sledování po léčbě by měly být tyto projevy aktivně vyhledávány a včas zmírňovány vhodnou podpůrnou léčbou. Doporučené postupy pro indikace k radioterapii i samotné plánování léčby v konkrétních případech má být vždy vedeno tak, aby přínos léčby pro pacienta převyšoval rizika nežádoucích účinků, zejména pozdních, které dlouhodobě nepříznivě ovlivňují kondici a kvalitu života pacienta.
5.3.3 o vlivnění fertility, ovariálních hormonálních funkcí a sexuálního života
V případě indikace radioterapie na oblast pánve u mladých žen vzniká riziko ztráty hormonálních funkcí ovarií a ztráta fertility z důvodu vysoké radiosenzitivity ovariálních tkání. S ohledem na charakter nádorového onemocnění a přijatelnost zdržení léčby je vhodné provést před plánováním radioterapie transpozici ovarií mimo ozařovaný objem a při plánování léčby zajistit co
nejnižší radiační zátěž transponovaných ovarií za účelem záchovy hormonálních funkcí. Vzhledem k velmi vysoké radiosenzitivitě zárodečných tkání je zachování fertility i po minimální radiační zátěži nejisté. Dle reprodukčních plánů pacientky je proto před léčbou zářením doporučena konzultace možností záchovy fertility v centru asistované reprodukce (CAR).
Častým nežádoucím účinkem po radioterapii pánve je vaginální stenóza a suchost sliznice nebo vznik adhezí, které mohou vést až k obliteraci pochvy. Tyto změny výrazně ovlivňují kvalitu života pacientek, vedou k dyspareunii a dalším komplikacím sexuálního života. Chybí přesnější doporučení pro zjišťování, klasifikaci a léčbu těchto obtíží. Je doporučena dilatace pochvy, zvlhčující přípravky s kyselinou hyaluronovou, v indikovaných případech může přinést efekt lokální aplikace estrogenů a slibné výsledky se ukazují též po užití laserové terapie.
pacienta a k ozáření cílového objemu v těle pacienta dochází zvenku přes kůži. Hodnota absorbované dávky v oblasti svazku záření je dána kvalitou záření (druh, energie, biologická účinnost), velikostí a tvarem ozařovacího pole, vzdáleností zdroje od kůže, hloubkou, kde je ložisko uloženo, a dalšími faktory. Podle uvedených faktorů se liší profil průniku dávky do hloubky tkání a lokalizace oblasti s maximální dávkou. Volbu ozařovací techniky proto volíme v závislosti na záměru léčby a parametrech uložení cílového objemu tak, aby bylo dosaženo optimálního výsledku.
5.4.1 3D konformní radioterapie
pamatuj
» Radioterapie na oblast pánve vede ke sterilitě a ztrátě hormonálních funkcí ovarií.
» Před radioterapií:
– u premenopauzálních žen zvážit možnost transpozice ovarií
– u pacientek s nedovršenými reprodukčními plány zajistit konzultaci v caR
» Po radioterapii může být výrazně zhoršena kvalita sexuálního života (suchost, stenóza, obliterace pochvy).
5.4 zEV ní ra D iot E rapi E
z ákla D ní fakta
• Zevní radioterapie – zdroj je umístěn mimo tělo pacienta
• 3D- c Rt – plánovaná dávka dobře odpovídá cílovému objemu
• i MRt – technika radioterapie s přesnější dávkovou distribucí a lepším šetřením rizikových struktur
• VMat, tomoterapie – další techniky zlepšující možnosti IMRT
• ig Rt – obrazem řízená radioterapie – přesnější kontrola polohy pacienta díky integrovanému zobrazovacímu systému
• 4D radioterapie – přesnější zohlednění dýchacích pohybů orgánů
• Stereotaktická radioterapie – přesné doručení vyšší dávky do malého cílového objemu
Při zevní radioterapii (EBRT – external beam radiation therapy) je zdroj ionizujícího záření umístěn mimo tělo
3D konformní radioterapie (3D-CRT) je základní technika radioterapie, která využívá 3D plánování na podkladě snímků ze zobrazovacích metod. Ve snímcích jsou definovány cílové objemy pro ozáření a rizikové struktury, poté je vypočten ozařovací plán; ozářený objem dobře odpovídá zakreslenému cílovému objemu. Ozáření je provedeno z více směrů, paprsek je tvarován staticky pomocí mnoholistového kolimátoru.
5.4.2 radioterapie s modulovanou intenzitou
S rozvojem technologií v radioterapii souvisí také snaha o zlepšení terapeutického poměru, tedy zvýšení dávky v cílovém objemu a snížení zatížení rizikových struktur v okolí díky strmějšímu gradientu dávky kolem PTV. Byly vyvinuty pokročilejší metody radioterapie – IMRT (Intensity Modulated Radiation Therapy – radioterapie s modulovanou intenzitou), kdy se svazek záření lépe přizpůsobuje cílovému objemu – je možné měnit intenzitu (fluenci) svazku, využívat dynamický mnoholistový kolimátor a ozařovat z více směrů, což ve výsledku vede k přesnější dávkové distribuci. Další techniky využívají rotaci zdroje okolo pacienta s kontinuální modulací svazku – VMAT (Volumetric Modulated Arc Therapy), tomoterapie a další. Pomocí těchto technik je možné definovat různé dávky do jednotlivých částí cílového objemu – simultánní integrovaný boost (SIB) – obr. 5.3.
Výhodou těchto systémů je možnost preciznější dávkové distribuce, tvarování konkavit cílových objemů a lepší šetření rizikových struktur v okolí ozařovaného objemu (střeva u ozařování v pánvi, mícha u ozařování krku atd.) – viz obr. 5.2. Při užití těchto technik v oblastech s větším rozsahem intrafrakčních pohybů orgánů bez monitorace těchto pohybů (zejména dechové objemy



obr. 5.3 Ozařovací plán pro zevní radioterapii – simultánní integrovaný boost (SIB). Technika IMRT VMAT, koronární a transverzální řez. Dose volume histogram (DVH) – zobrazení dávkové distribuce v oblasti cílových objemů a rizikových struktur. Izodózy: červená – 100 % předepsané dávky na posti žené uzliny, oranžová – 100 % předepsané dávky na celý objem, modrá – 70 % předepsané dávky.
v oblasti hrudníku a epigastria) může docházet k větší nejistotě stran doručení dávky. Proto v některých případech zůstává výhodou užití 3D-CRT poskytující zde robustnější dávkovou distribuci.
5.4.3 obrazem řízená radioterapie
K dosažení maximální přesnosti ozáření je nezbytná kontrola polohy pacienta před každou frakcí léčby. Toho je dosaženo díky integraci zobrazovacích systémů do ozařovacích přístrojů. Snímky provedené před zahájením každé frakce ozáření jsou porovnány s plánovacími snímky a odchylky jsou korigovány za účelem maximální přesnosti léčby. Jsou využívány rentgenové snímky ve dvou projekcích nebo zjednodušené CT zobrazení (CBCT – cone beam CT) – obr. 5.4. Využívání této technologie se nazývá obrazem řízená radioterapie (IGRT – Image Guided Radiation Therapy).
5.4.4 4D radioterapie
V oblastech s dechovým pohybem orgánů (hrudník, epigastrium) je pro větší přesnost léčby vhodné využít některou z forem monitorace dechových pohybů. Respiratory gating je způsob sledování dýchání pacienta, kdy se poté ozáření provádí pouze v určitém rozsahu dechových pohybů nebo jen v určité dechové fázi – typicky v nádechu. Jinou možností je respiratory tracking, při němž ozařovač sleduje dechové pohyby tumoru v reálném čase díky integrovaným zobrazovacím systémům.
5.4.5 stereotaktické ozařování Stereotaktická radioterapie představuje aplikaci vyšší dávky záření do malého objemu tkáně, většinou v 1–5 frakcích. Charakteristický je malý dobře ohraničený cílový objem, nehomogenita ozáření a těsné pokrytí PTV předepsanou dávkou se strmým spádem dávky
a uterovaginální aplikátor
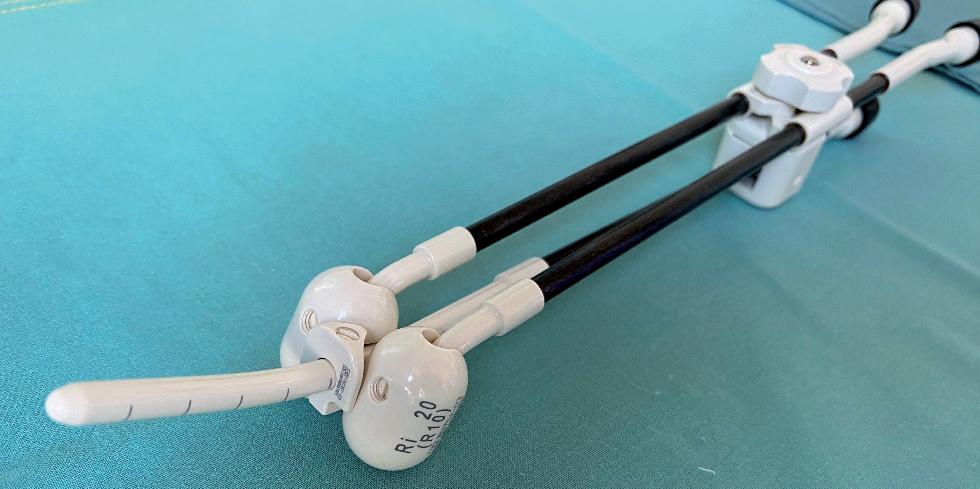
b kolpostat

c y-sonda

d Heymanova tamponáda

e vaginální válec

obr. 5.5 Typy aplikátorů pro brachyterapii v onkogynekologii.
a) Uterovaginální aplikátor – pro radikální léčbu karcinomu hrdla dě‑ ložního, b) kolpostat – pro adjuvantní léčbu karcinomu hrdla děložního,
c) Y‑sonda, d) Heymanova tamponáda – oba aplikátory pro radikální léčbu karcinomu děložního těla, e) vaginální válec – pro adjuvantní léčbu karcinomu děložního těla
obr. 5.6 Pravidla zakreslování cílového objemu při 3D plánování brachyterapie podle doporučení GEC ESTRO


obr. 5.7 Regrese tumoru hrdla děložního na MRI snímcích (sagitální řezy) – srovnání snímků a) před zahájením léčby, b) po dokončení zevní radiote‑ rapie (před první aplikací BRT, zaveden UVAG aplikátor)
25 frakcí à 1,8 Gy. V případě přítomnosti neresekované lymfadenektomie jsou uzliny ozařovány technikou SIB frakcionací 25× 2,2–2,3 Gy do dávky 55–57,5 Gy – viz obr. 5.3. Brachyterapie se provádí po dokončení zevní radioterapie, kdy bývá obvykle tumor ve významné regresi velikosti (obr. 5.7), UVAG aplikátorem ve 4 frakcích dle radiologických standardů do celkového ekvivalentu dávky (EQD2) minimálně 90 Gy na reziduální tumor (GTVres a minimálně 75 Gy (EQD2) na HR-CTV. Cílový objem pro BRT viz kap. 5 Radioterapie a obr. 5.6 a 5.8. U objemnějších tumorů je vhodné využití kombinované intrakavitální a intersticiální aplikace pomocí jehel, které mohou zlepšit pokrytí cílového objemu. Celkový čas léčby by ideálně neměl přesáhnout 50 dnů.
Pro doručení dostatečně účinné dávky na oblast primárního tumoru hrdla děložního zůstává BRT nezbytná. Tato metoda zaručuje největší přínos pro pacientky stran přežití bez nemoci a celkového přežití; boost pomocí různých technik zevní radioterapie vykázal ve studiích horší výsledky. Brachyterapie má však i své limitace, zejména u pacientek s objemným tumorem prorůstajícím do močového měchýře nebo rekta. V těchto případech je vyšší riziko vzniku vezikovaginálních a rektovaginálních píštělí a indikace BRT UVAG musí být individuálně zhodnocena.
Průběh léčby může komplikovat neoptimální uložení zavedeného aplikátoru, což znesnadňuje pokrytí tumoru potřebnou dávkou záření, případně může dojít i k vážnější komplikaci ve formě perforace dělohy. Těmto nežádoucím příhodám lze předejít zaváděním aplikátoru pod kontrolou onkogynekologickým ultrazvukem.

obr. 5.8 Ozařovací plán pro BRT hrdla děložního – MRI snímek, koro‑ nární řez, zaveden UVAG aplikátor. Oranžová přerušovaná čára – HR CTV (high risk Clinical Target Volume), růžová přerušovaná čára – IR CTV (in‑ termediate risk Clinical Target Volume), ostatní přerušované čáry – riziko‑ vé orgány, plné čáry – izodózy: červená – 100 % dávky, růžová – 75 % dávky, modrá – 50 % dávky
pamatuj
» uterovaginální brachyterapie je nezbytnou součástí radi‑ kální nechirurgické léčby karcinomu děložního hrdla; nelze adekvátně nahradit jiným způsobem.
» uterovaginální a intersticiální brachyterapie jsou prováděny obvykle v celkové anestezii.
