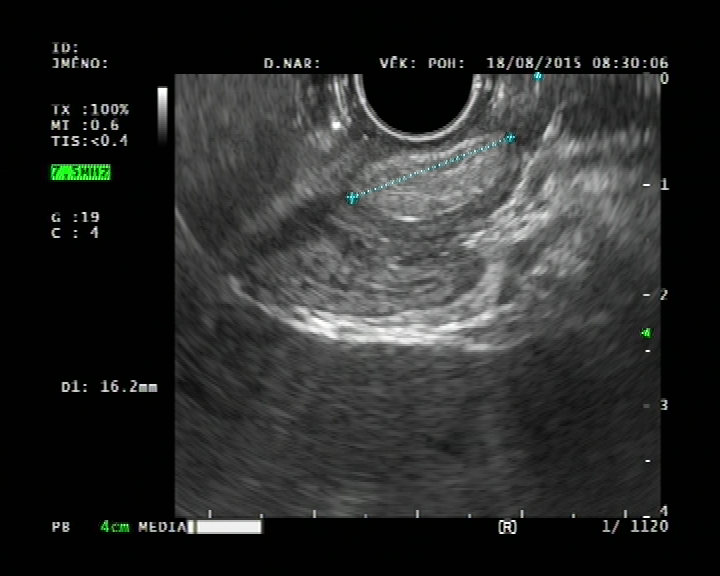
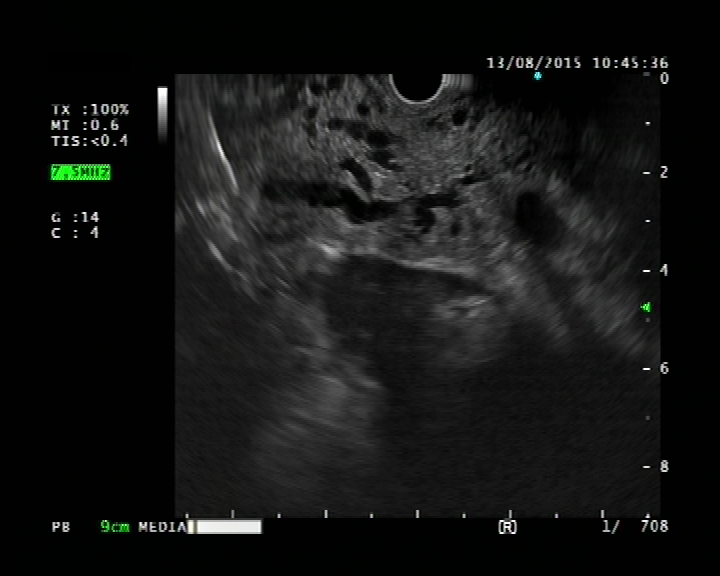
Subepiteliální – neepitelové tumory dělíme na intramurální a extramurální. Prevalence jakéhokoliv „vyboulení“ krytého normální sliznicí v průběhu endoskopie horní části trávicího traktu je 0,36 % (1). Dříve byly tyto léze nesprávně označovány jako „submukózní“, ale toto označení popisuje pouze tumory vycházející z vrstvy submukózy, a je tedy je nepřesné. V rámci diferenciální diagnózy mohou subepiteliální léze vycházet z kterékoliv vrstvy stěny žaludku 1.– 5. I podle toho, z jaké vrstvy léze či tumor vychází, je možné rozlišit typy nádorů. Identifikace přechodové zóny je pro endosonografistu zásadní, označuje se jako „přechodová zóna“. Mezi další kritéria hodnocení, která pomáhají v diferenciální diagnostice, jsou: velikost, echogenita tumoru, okraje a obsah tumoru a vaskularita (tab. 2) (2).
Tabulka 2 – EUS charakteristika subepiteliálních lézí
|
EUS charakteristiky subepiteliálních lézí |
||
|
Příčina |
EUS vrstva |
EUS vzhled |
|
GIST |
4. (vzácně 2.) |
Hypoechogenní (nepravidelné okraje, echogenní oblasti se smíšenou echogenitou, anechogenní oblasti naznačují malignitu) |
|
Leiomyom |
4., 2. |
Hypoechogenní |
|
Aberantní pankreas |
2., 3. a/nebo 4. |
Hypoechogenní nebo smíšené echogenity |
|
Lipom |
3. |
Hyperechogenní |
|
Karcinoid |
2. a/nebo 3. |
Mírně hypoechogenní, homogenní |
|
Granular cell tumor |
3. nebo 4. |
Homogenní hypoechogenní masa s hladkými okraji |
|
Cysty |
3. |
Anechogenní, okrouhlá či oválná (duplikační cysta s 3/5 vrtvami) |
|
Varixy |
3. |
Anechogenní, tubulární, serpiginózní |
|
Zánětlivý fibroid polyp |
2. a/nebo 3. |
Hyperechogenní, homogenní či smíšené echogenity, neostré okraje |
|
Glomus tumor |
3. nebo 4. |
Hypoechogenní, hladký okraj, vnitřní heterogenní echo, vysoce echogenní body |
|
Lymfom |
2., 3. a/nebo 4. |
Hypoechogenní |
|
Metastázy |
jakákoliv nebo všechny |
Hypoechogenní, heterogenní |
Provedením EUS FNA tumoru se diagnostická přesnost proti EUS samotné téměř zdvojnásobí z 45,5%–82,9 % na 63%–98 % (3, 4). Ve srovnání z CT vyšetřením je EUS přesnější, celková přesnost CT v detekci a klasifikaci subepiteliálních lézí je 85,3 % a 78,8 %.
Gastrointestinální stromální tumor (GIST)
Mezi nejčastější intramurální tumory žaludku patří gastrointestinální stromální tumory. Dříve byly chybně považovány za leiomyomy či leiomyosarkomy hlavně proto, že EUS přechodová zóna je často ve svalovině. GIST představují 80 % všech mezenchymových tumorů žaludku. Až 10–30 % gastrointestinálních tumorů je maligních (9). Označení „benigní“ není při popisu GIST vhodné a jejich charakter dle konsenzu patologů o riziku malignity se vyjadřuje stupnicí: velmi nízké riziko, nízké riziko, střední riziko a vysoké riziko malignit podle velikosti tumoru a mitotického počtu v odebraném vzorku (10). Histologická charakteristika (8) a hodnocení stupně malignity je uvedeno v kapitole 4. Většina GISTů menších než 2 cm je klinicky buď asymptomatická nebo, v případě tumorů větších než 2 cm, se projeví neurčitým břišním dyskomfortem či mírnou bolestí. Velké tumory mívají typickou ulceraci na vrcholu a jedním z prvních projevů bývá krvácení do GITu či ztrátová anémie.
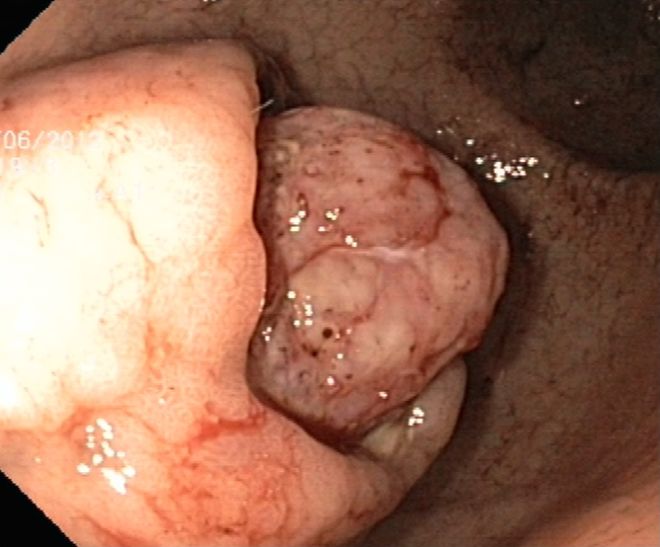
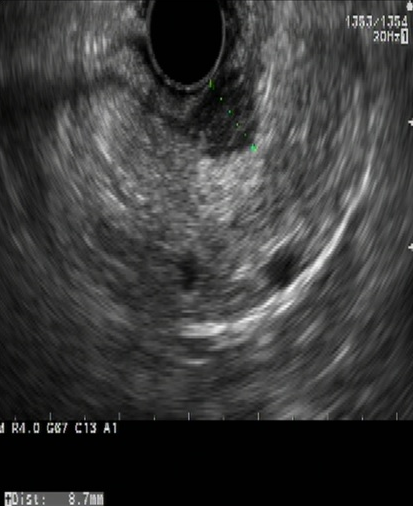
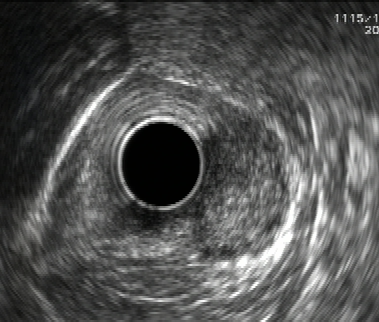
Endosonograficky jsou GIST většinou relativně homogenní, hypoechogenní a dobře ohraničené a ve většině případů vyrůstají ze svalové vrstvy muscularis mucosae nebo častěji z muscularis propria. Rozlišit GIST, schwannom a leiomyom jen podle EUS je nemožné. V jedné studii byly u GIST častěji než u leiomyomů pozorovány nehomogenita, hyperechogenní okrsky, hypoechogenní haló a vyšší echogenita ve srovnání s vrstvou svaloviny v přechodové zóně. Přítomnost dvou ze čtyř těchto znaků mělo senzitivitu 89,1 % a specificitu 85,7 % v predikci GIST (11) (obr. 2A, 2B, 3A, 3B).
Obrázek 2A – Endoskopický pohled v EUS – obraz GIST
Obrázek 2B – Endoskopický pohled v EUS – obraz leiomyomu
Obrázek 3A – GIST s rizikem krvácení
Obrázek 3B – GIST napodobující leiomyom
Predikce maligního potenciálu GIST založená na EUS charakteristice tumorů není zcela přesná. V několika studiích byly vybírány různé EUS charakteristiky, ale jen velikost tumoru byla uznána jako definitivní prediktivní faktor. Mezi potenciální prediktivní faktory, vyjadřující možný maligní potenciál, patří endoskopický nález slizničního vředu a různé EUS známky: nepravidelný tvar a okraje, heterogenita, marginální haló a extraluminální růst. Vnitřní anechogenní komponenta koreluje s velikostí a je pokládána za známku možné progrese růstu tumoru (12).
Vyšetření pomocí kontrastní endosonografie zavedeno v posledních letech bude, jak se zdá, také přínosem v diferenciální diagnostice. Identifikace nepravidelných cévních struktur uvnitř tumoru mělo přesnost 83 % v predikci malignity, výsledek srovnatelný s přesností FNA (13). Při FNA také nelze přesně s jistotou vyloučit maligní potenciál tumoru. Speciální barvení na ki-67 (MIB-1), marker buněčné proliferace, umožní přesnější určení maligního potenciálu tumoru s vyšší přesností (14).
Mezenchymální tumory menší než 1 cm nenesou téměř žádný maligní potenciál, EUS sledování je možné doporučit, ale oficiální guideline není stanoven. Léze velikosti mezi 1–3 cm je možné vyšetřit pomocí CEH EUS a FNA. Při známkách malignity či růstu je možné doporučit resekci chirurgickou či ESD podle zkušeností pracoviště. Tumory větší než 3 cm jsou indikovány k chirurgické resekci.
Aberantní pankreas
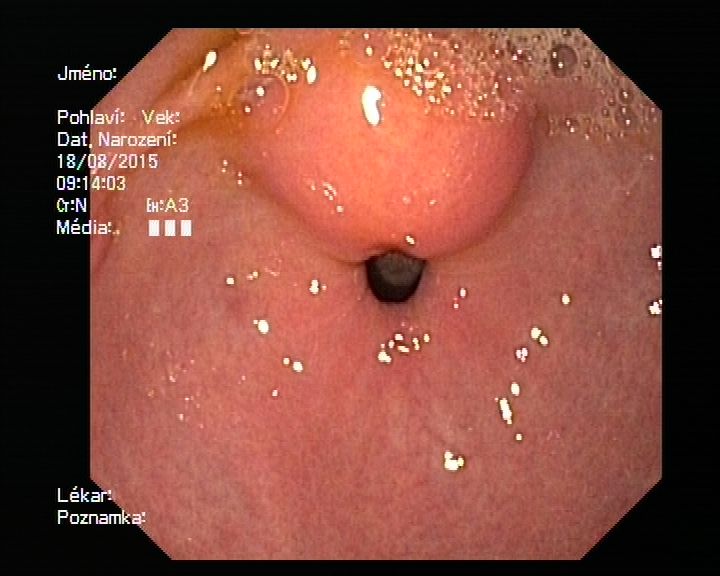
Termín aberantní pankreas používáme k označení ektopické pankreatické tkáně lokalizované mimo anatomickou či cévní spojitost s vlastní tkání pankreatu. Mezi jiné běžně používané termíny patří: ektopický pankreas, „pancreatic rest“ a heterotopický pankreas. Typicky bývá objeven náhodně během endoskopického vyšetření. Lokalizace je nejčastěji v oblasti antra na velké křivině, ale i v duodenu, tenkém střevě či kdekoliv v GIT. Incidence odhadovaná na základě autopsií je mezi 0,6 % a 13,7 %, v rámci břišních operací je náhodně zachycen při přibližně každém 500stém výkonu (15). Pacienti s aberantním pankreatem jsou většinou asymptomatičtí, nicméně vzácně se mohou objevit komplikace jako pankreatitida, formace cyst, vředy a krvácení, porucha vyprazdňování žaludku, obstrukční ikterus i karcinom (15, 16).
Endoskopicky nacházíme aberantní pankreas jako nevelké vyklenutí typicky v antru s centrálním „pupíkem“ odpovídajícím drénujícímu vývodu (obr. 4A). Vychází zejména ze submukózy, muscularis propria, ale teoreticky i z hluboké mukózy a serózy (obr. 4B). Vzhledem odpovídá struktuře parenchymu pankreatu, je převážně hypoechogenní (acíny) s hyperechogenními strukturami (tuková tkáň), můžeme odhalit i struktury pankreatického vývodu (17). Léčba je závislá od symptomů, v případě, že není postižena muscularis propria, je možná endoskopická resekce, v jiném případě je preferován chirurgický výkon.
Obrázek 4 – Aberantní pankreas
4A – endoskopický obraz
4B – EUS obraz
Lipom
Lipomy jsou benigní tumory složené z lipocytů. Bývají zachyceny náhodně, častěji v dolní části trávicí trubice než v horní, a jsou většinou asymptomatické. Vzácně se mohou projevit krvácením, břišní bolestí či intestinální obstrukcí (18). Endoskopický obraz typického lipomu (obr. 5A) je malé vyklenutí nažloutlé barvy, při zatlačení kleštěmi do povrchu zůstává patrný otlaček, „příznak polštáře“. V EUS obraze jde téměř vždy o hyperechogenní bulku vycházející z 3. vrstvy, ze submukózy (obr. 5B).
Obrázek 5A – Endoskopický obraz lipomu
Obrázek 5B – EUS obraz lipomu
Většinu lipomů lze diagnostikovat endoskopicky či pomocí EUS. V případě diagnózy není nutná zvláštní léčba, ta je doporučovaná pouze v případě symptomatických lipomů. Někdy může být obtížné rozlišit lipom a velmi vzácnou maligní variantu liposarkom (19).
Karcinoid tumor
Karcinoid je vzácný tumor, patří mezi pomalu rostoucí neuroendokrinní tumory. Nejčastější lokalizace v GIT je apendix, rektum, žaludek a tenké střevo. Kromě GITu často vyrůstá i v plicích. Velmi často bývá asymptomatický, v případě symptomů se projeví bolestí břicha, někdy krvácením či intestinální obstrukcí. Typickým projevem je tzv. karcinoidový syndrom.
Při endoskopii lze pozorovat solitární malé přisedlé okrouhlé polypoidní léze s hladkým povrchem a žlutavým odstínem, zřídka s vředem. V EUS obraze je homogenní, dobře ohraničený, mírně hypoechogenní či izoechogenní masa. Vychází z hluboké mukózy a invaduje hlouběji do submukózy, proto je obvykle biopsie z hluboké mukózy diagnostická a postačuje (20). Tumory menší než 2 cm a bez lymfadenopatie je možné odstranit endoskopicky metodou endoskopické mukozální resekce (EMR) (21). EUS pomáhá odhalit případnou hlubší invazi do vrstvy svaloviny, umožňuje detailní měření tumorů a detekci případné lymfadenopatie.
Granular cell tumor
Granular cell tumor (GCT) je vzácný nádor odvozený z nervové tkáně. Granularita buněk je daná nahromaděním lysozomů uvnitř buněčné cytoplazmy. Tumor se nachází kdekoliv v GIT v podobě malých nodulů v mukóze a submukóze s možnou invazí do muscularis propria. V EUS obraze jde o hypoechogenní okrouhlé léze velmi podobné leiomyomům. Z dalších lokalizací se GCT vyskytuje v laryngu, bronších, žlučníku a žlučovém systému. Mezi GIT lokalizací je nejčastějším místem jícen, žaludek je postižen asi v 10 %. Většina je benigních, jen 2–3 % jsou maligní, hlavně tumory větší než 4 cm. K definitivnímu odlišení od jiných tumorů je nutná imunohistochemická analýza. Lze očekávat pozitivitu v barvení PAS, dále S-100 protein +, neuron specifickou enolázu +, negativitu desminu a vimentinu (22). U asymptomatických GCT se doporučuje sledování co 1–2 roky k posouzení růstové progrese, malé tumory lokalizované v mukóze mohou být endoskopicky odstraněny.
Cysty žaludku, duplikační cysta
Cysty jsou v ultrazvukovém obraze anechogenní, vzácnější je vzhled hypoechogenní s bodovými echogenitami. Subepiteliálně uložené cysty žaludku lze rozdělit na tři typy: jednoduché cysty, multicystické léze a solidně cystické tumory (23).
Žaludeční cysty jsou klinicky velmi vzácné, většinou asymptomatické. Vznikají na podkladě proběhlého zánětu, jsou anechogenní, echoprázdné, dobře ohraničené s hyperechogenní stěnou a typickým dorzálním zesílením. Při FNA, které je indikováno v případě nalezené solidní komponenty uvnitř cysty, je nutné myslet na možné komplikace a před výkonem zajistit podání antibiotik.
Duplikační cysty lze najít v průběhu celého trávicího traktu, žaludek je nejméně častým místem jejich výskytu. V EUS obraze může být obsah mírně transparentní, většinou anechogenní a homogenní, vychází z 3. vrtsvy submukózy (24). Duplikační cysty mají nízký maligní potenciál, malignizace byla popsaná jen kazuisticky. Mezi možné symptomy patří dysfagie, krvácení, bolesti břicha a pankreatitida, v případě, že je cysta lokalizovaná u Vaterské papily.
Varixy žaludku
Žaludeční varixy, nalezeny náhodně při endoskopickém vyšetření horní části trávicího traktu, mohou činit diferenciálně diagnostické rozpaky. V případě, že nejsou k dispozici další klinické informace a nález je z varixů suspektní, není vhodné provádět biopsii před EUS vyšetřením pro riziko krvácení. Při EUS fundické varixy mají vzhled malých oválných ohraničených anechogenních struktur v submukóze, početnější než prosté cysty. V případě progrese velikosti jsou serpiginózní varixy často doprovázeny cévními perigastrickými kolaterálami. Definitivní diagnózu umožní vyšetření dopplerem, typický obraz na příčném průřezu má vzor „švýcarského sýra“ (25). EUS je možné použít i v terapii varixů pomocí injekce sklerotizující látky do žilních spojek varixů (26, 27). Terapie gastrických varixů je bezpečná a vysoce efektivní i z transezofageálního přístupu (obr. 6) (28).
Obrázek 6 – Varixy žaludku
Zánětlivý fibroidní polyp
Fibroidní polyp je vzácný benigní polyp typicky nalézaný v žaludku, a jen vzácněji jinde v zažívací trubici. Lokalizace je zejména v antru žaludku, endoskopický vzhled je různorodý: erytém na řase, protruze, eroze až ulcerace či bělavé čepičky na povrchu, či deprese uprostřed ploché léze. Histologicky je obtížné fibroidní polyp diagnostikovat (obr. 7) (29).
Obrázek 7 – Fibroidní polyp
7A – endoskopický obraz
7B – EUS obraz
Endosonograficky vychází z vrstvy hluboké mukózy a zasahuje do submukózy, je homogenní s nezřetelným lemem. Histologicky dominuje proliferující fibroidní tkáň bez kapsuly s vaskulárními elementy a eozinofilní infiltrací. V některých případech v EUS lze zachytit hyperechogenity, korespondující s cévními strukturami (30).
Diferenciální diagnóza je obtížná, nelze zcela jistě tento polyp odlišit od karcinoidu, GIST, leiomyomu, eozinofilní gastritidy, hemangiopericytomu či hemangioendoteliomu. Resekce endoskopickou metodou, pokud to velikost umožňuje, je metodou volby. Cílem je dosažení zdravého okraje k prevenci často popisované recidivy (31).
Glomus tumor
V termoregulačním tělísku se nacházejí buňky hladké svaloviny. Glomus tumor vychází z modifikovaných buněk neuromyoarteriálního receptoru. Většina je benigních, byly však popsány i maligní formy. Někdy se mohou tyto tumory projevit krvácením do GIT, jindy jsou asymptomatické. V žaludku vychází z 3. a 4. vrtsvy, má vzhled hypoechogenní masy s hyperechogenním tečkováním, často s marginálním anechogenním lemem. Na CT se jeví jako homogennní hyperintenzní zesílení v časné i pozdní fázi (32).
Vzácné nálezy
V literatuře je popisovaných mnoho vzácných nálezů, ale pouze jako jednotlivá kazuistická sdělení. Popsat typický endosonografický či endoskopický vzhled je v případě takto vzácných nálezů neracionální.
Glandulární cysta, vzhledem malá, nodulární či polyploidní léze v těle žaludku. Tvoří „interní hyperecho“ ve vrstvě mukózy, bez narušení normální struktury stěny žaludku (25).
Lymfomy vzácně tvoří pseudotumorózní masy v žaludku, EUS vzhled je hypoechogenní, vycházejí z 2., 3. vrtsvy, ale mohou invadovat i do hlubších vrstev stěny žaludku. Metastázy vzdálených tumorů vypadají v EUS obraze jako hypoechogenní léze a mohou postihovat kteroukoliv část stěny žaludku. Některé lze diagnostikovat pouhým endoskopickým vyšetřením bez nutnosti provádět EUS (obr. 8). Linitis plastica je biopticky často obtížně diagnostikovatelná. V EUS obraze bývá patrné ztluštění všech vrstev stěny žaludku, endoskopicky bývá patrná porucha pasáže žaludku.
Odběr tkáně k histologickému vyšetření subepiteliálních lézíí
V rámci rutinní endoskopické diagnostiky subepiteliálních lézí je indikovaná biopsie sliznice, která kryje různá vyklenutí, bulky či tumory. Při cystickém či vaskulárním vzhledu je však biopsie před provedením EUS kontraindikovaná pro vysoké riziko krvácení.
Při odběru tkáně bioptickými kleštěmi je výtěžnost histologické diagnostiky nízká, ani FNA není zcela optimální. Je vypracováno několik základních technik odběru tkáně, nicméně je nutné počítat s možnou následnou endoskopickou resekcí a tím, že po extenzivních pokusech o biopsii může docházet k jizvení (33, 34, 35). Průměrně je v různých studiích hlášena asi 80 % přesnost FNA biopsie (36).
Doporučený postup diagnostiky, léčby a sledování subepiteliálních lézí
Na základě toho, ze které vrstvy subepiteliální tumory vycházejí, je daný diagnosticko – léčebný algoritmus subepiteliálních lézí (obr. 9). Extraluminální komprese přilehlým orgánem a benigní submukózní léze jako lipomy či jednoduché cysty nevyžadují další léčbu či sledování. Heterotopická pankreatická tkáň, zánětlivý fibroidní polyp je vhodné sledovat. Suspektní povrchové léze, jako karcinoid, mohou být diagnostikovány pomocí slizniční biopsie. Na hlouběji uložené léze je vhodné využít EUS FNA. Na malé léze vycházející ze submukózy nebo vnitřního listu muscularis propria je lépe využít ESD. Nad lézemi, kde nebyla učiněna diagnóza, je doporučen endoskopický a endosonografický dohled. Při sledování suspektních lézí by měl být interval kontrol přibližně jednou ročně, s přihlédnutím k nálezům i častěji. Při negativním nálezu dvou po sobě následujících kontrol je doporučeno interval následující kontroly prodloužit (37).

Subepiteliální léze jsou omezeně vyšetřitelné konvenčními endoskopickými metodami, CT i MRI, a diagnostika pomocí biopsie je často nepřesná. EUS vyšetření vrstev stěny umožňuje zpřesnit diagnostiku tumorů žaludku. Všechny léze větší než 1 cm a které neimponují primárně jako cysta či lipom jsou indikovány k EUS vyšetření. I když je EUS přesná, není možné pouze tímto vyšetřením rozlišit maligní a benigní léze, zejména pak maligní potenciál GIST. Zpřesnění přináší kombinace s punkcí tenkou jehlou-EUS FNA a spolu s CEH EUS zvyšuje celkovou přesnost vyšetření. EUS může zpřesnit selekci pacientů k endoskopické resekci sliznice a submukózy (ESD a EMR) odhadem hloubky invaze nádoru.